
-
 Jovanotti, "da oggi sono Commendatore della Repubblica, grande onore"
Jovanotti, "da oggi sono Commendatore della Repubblica, grande onore"
-
Trovato il freno del principale tumore cerebrale pediatrico
-
 Borsa: Milano e l'Europa forti dopo l'indicazione di Warsh alla Fed
Borsa: Milano e l'Europa forti dopo l'indicazione di Warsh alla Fed
-
Putin riceve il capo del Consiglio di sicurezza iraniano Larijani

-
 F1: le Ferrari brillano nell'ultimo giorno di test a Barcellona
F1: le Ferrari brillano nell'ultimo giorno di test a Barcellona
-
Hit parade, Geolier si conferma in vetta ad album e singoli

-
 Spuntano a Liverpool le prime immagini dei 'Beatles' di Mendes
Spuntano a Liverpool le prime immagini dei 'Beatles' di Mendes
-
Il gas conclude in rialzo (+1,8%) a 39,2 euro al Megawattora

-
 Vitagliano, 'le raccomandazioni sono ovunque, anche in tv'
Vitagliano, 'le raccomandazioni sono ovunque, anche in tv'
-
Ghost torna al cinema in versione restaurata 4K per San Valentino

-
 Satelliti Ue rilevano i maggiori incendi in 20 anni in Patagonia
Satelliti Ue rilevano i maggiori incendi in 20 anni in Patagonia
-
ll Rof si esibisce a Pechino per il 55/o delle relazioni Italia-Cina
-
 Il Dipartimento di Giustizia Usa pubblica nuove carte su Epstein
Il Dipartimento di Giustizia Usa pubblica nuove carte su Epstein
-
Le cellule tumorali diventano più aggressive se sono compresse

-
 Voci di mercato, Mateta non convocato dal Crystal Palace
Voci di mercato, Mateta non convocato dal Crystal Palace
-
Verso Pordenone 2027, presentato il nuovo sito

-
 Champions: playoff; si parte con Galatasaray-Juventus martedì 17 febbraio
Champions: playoff; si parte con Galatasaray-Juventus martedì 17 febbraio
-
I Trump bloccano la stampa alla prima di 'Melania'

-
 Red Bull Ivy 2026, lo spettacolo dell' arrampicata si accende
Red Bull Ivy 2026, lo spettacolo dell' arrampicata si accende
-
Sindacati, domani sciopero di 4 ore del personale navigante di EasyJet

-
 Venezuela, le autorità elettorali sospendono l'iscrizione di nuovi partiti politici
Venezuela, le autorità elettorali sospendono l'iscrizione di nuovi partiti politici
-
Regina (Confindustria), 'Energia e bollette sono tema di sicurezza nazionale'

-
 Ex Ilva: Mimit, mandato a negoziato in esclusiva con Flacks, possibili partner
Ex Ilva: Mimit, mandato a negoziato in esclusiva con Flacks, possibili partner
-
Djokovic 'Sinner e Alcaraz livello super, ma si possono battere'

-
 I satelliti italiani Cosmo-SlyMed puntati sulla frana di Niscemi
I satelliti italiani Cosmo-SlyMed puntati sulla frana di Niscemi
-
Il Chelsea apre alla partenza di Disasi

-
 Borsa: Milano (+1%) solida con l'Europa dopo l'avvio di Wall street
Borsa: Milano (+1%) solida con l'Europa dopo l'avvio di Wall street
-
Wall Street apre in calo, Dj -0,32%, Nasdaq -0,33%

-
 In Austria il cancelliere Stocker invoca riforme, anche del servizio militare
In Austria il cancelliere Stocker invoca riforme, anche del servizio militare
-
'Franco Battiato. Un'altra vita', al Maxxi la mostra-evento sul musicista

-
 Il petrolio in calo a New York a 64,99 dollari
Il petrolio in calo a New York a 64,99 dollari
-
Delia, da X Factor al Sicilia Bedda Tour

-
 Vigilia di Grammy con Lady Gaga e Bieber sul palco
Vigilia di Grammy con Lady Gaga e Bieber sul palco
-
Piovani dirige Piovani per il Teatro Comunale di Bologna

-
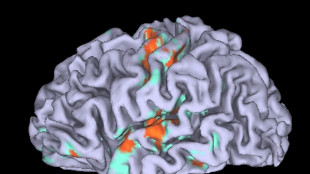 Cervello, con l'Alzheimer si inceppa il tasto 'replay' della memoria
Cervello, con l'Alzheimer si inceppa il tasto 'replay' della memoria
-
Sabato (Acea), 'per transizione servono regole chiare e tempi certi'

-
 La Bpco ha un nuovo respiro, a breve anche in Italia il primo farmaco biologico mirato
La Bpco ha un nuovo respiro, a breve anche in Italia il primo farmaco biologico mirato
-
Poligrafico dello Stato con l'Amerigo Vespucci vince il Ceda Michel Prieur 2025

-
 Josephine, il trauma della violenza negli occhi di una bambina
Josephine, il trauma della violenza negli occhi di una bambina
-
Ute Lemper torna in concerto ad aprile

-
 Torino: è arrivato Prati, visite mediche in corso
Torino: è arrivato Prati, visite mediche in corso
-
I nuovi farmaci antiobesità e antidiabete sono anche alleati della salute mentale

-
 Davis e Coltrane creatori di strade nuove, l' omaggio di Bergamo Jazz
Davis e Coltrane creatori di strade nuove, l' omaggio di Bergamo Jazz
-
Champions: Juve; Chiellini, 'Galatasaray forte, cambiamo ricordo 2013'

-
 Europa League: playoff, Bologna con il Brann
Europa League: playoff, Bologna con il Brann
-
Borsa: l'Europa accelera dopo l'annuncio di Trump per la Fed

-
 Atalanta: Marino, col Borussia Dortmund una sfida aperta e appassionante
Atalanta: Marino, col Borussia Dortmund una sfida aperta e appassionante
-
Luna, slitta di 48 ore la prova generale del lancio di Artemis II

-
 Snaidero, contratto solidarietà scongiura chiusura reparto
Snaidero, contratto solidarietà scongiura chiusura reparto
-
Media, Israele riaprirà domenica il valico di Rafah ai pedoni


Come il velcro, ecco come l'antibiotico attacca il batterio
Piccoli uncini adesivi, osservati per prima volta al microscopio
Aderisce ai batteri come il velcro, con tanti piccoli 'uncini' da cui è impossibile liberarsi: è il meccanismo d'azione della plectasina di cui si è osservato per la prima volta il comportamento in dettaglio e che potrebbe aprire nuove soluzioni per sviluppare gli antibiotici del futuro. A scoprire come riesce ad agganciarsi ai batteri bersaglio è stato il gruppo di ricerca guidato Markus Weingarth e dal biochimico Eefjan Breukink dell'Università di Utrecht in un lavoro pubblicato su Nature Microbiology. La plectasina è un antibiotico derivato da un fungo, Pseudoplectania nigrella, noto da una ventina di anni ed utilizzato per contrastare in particolare alcuni tipi di batteri resistenti ai trattamenti tradizionali. Per comprenderne meglio il meccanismo di azione i ricercatori lo hanno osservato usando alcune delle tecniche più avanzate di microscopia scoprendo che a differenza di quanto ipotizzato finora la plectasina non si lega alle cellule utilizzando una sorta di 'chiave' per agganciarsi alla parete esterna dei batteri bensì una sorta nastro di velcro. La plectasina, infatti, forma come tanti piccoli uncini che si agganciano a strutture simili ad anelli presenti sulla superficie batterica, un meccanismo che ricorda molto da vicino il velcro. Una tecnica che impedisce alla cellula di liberarsi dell'antibiotico e che, suggeriscono i ricercatori, potrebbe essere comune in gran parte degli antibiotici: "un meccanismo che era rimasto finora sconosciuto", ha detto Weingarth. "Il nostro studio - aggiunge - colma un'importante lacuna di conoscenze che potrebbe avere ampie implicazioni per la progettazione di farmaci migliori per combattere la crescente minaccia della resistenza antimicrobica".
T.Suter--VB
